anode가 양극이야 음극이야?
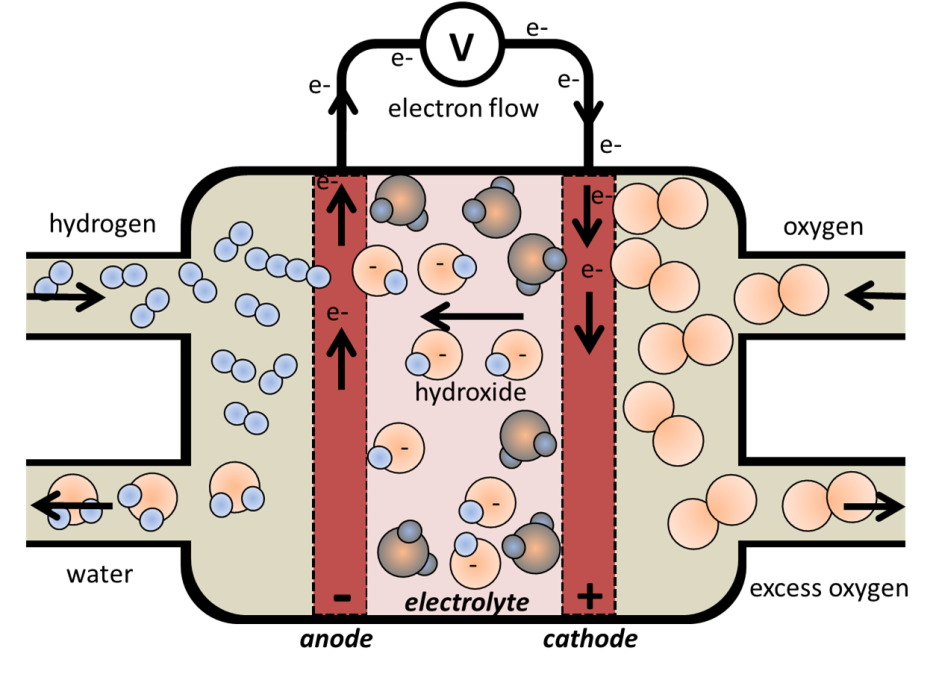
연료전지의 대표적인 구조와 동작원리는 아래와 같습니다.
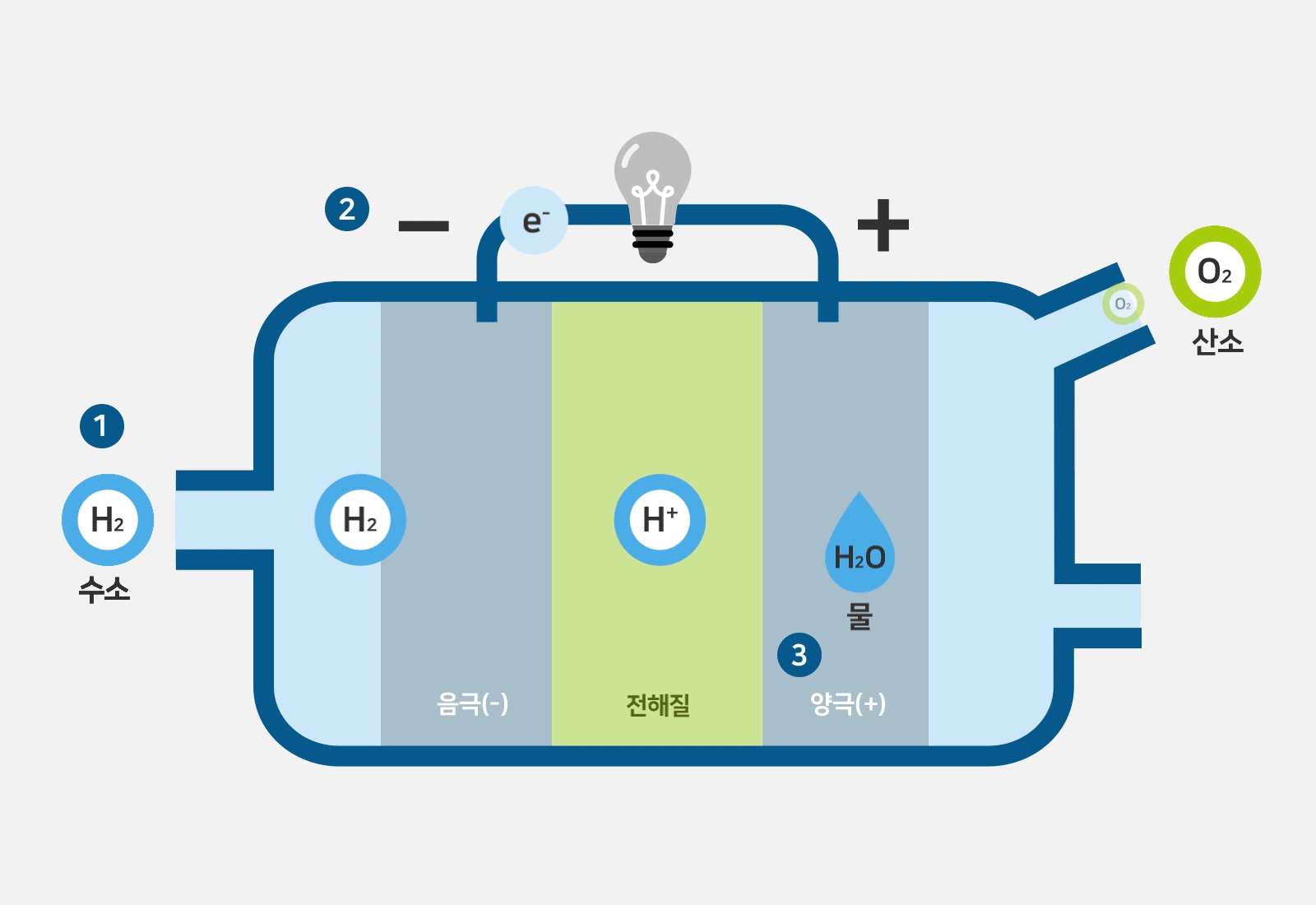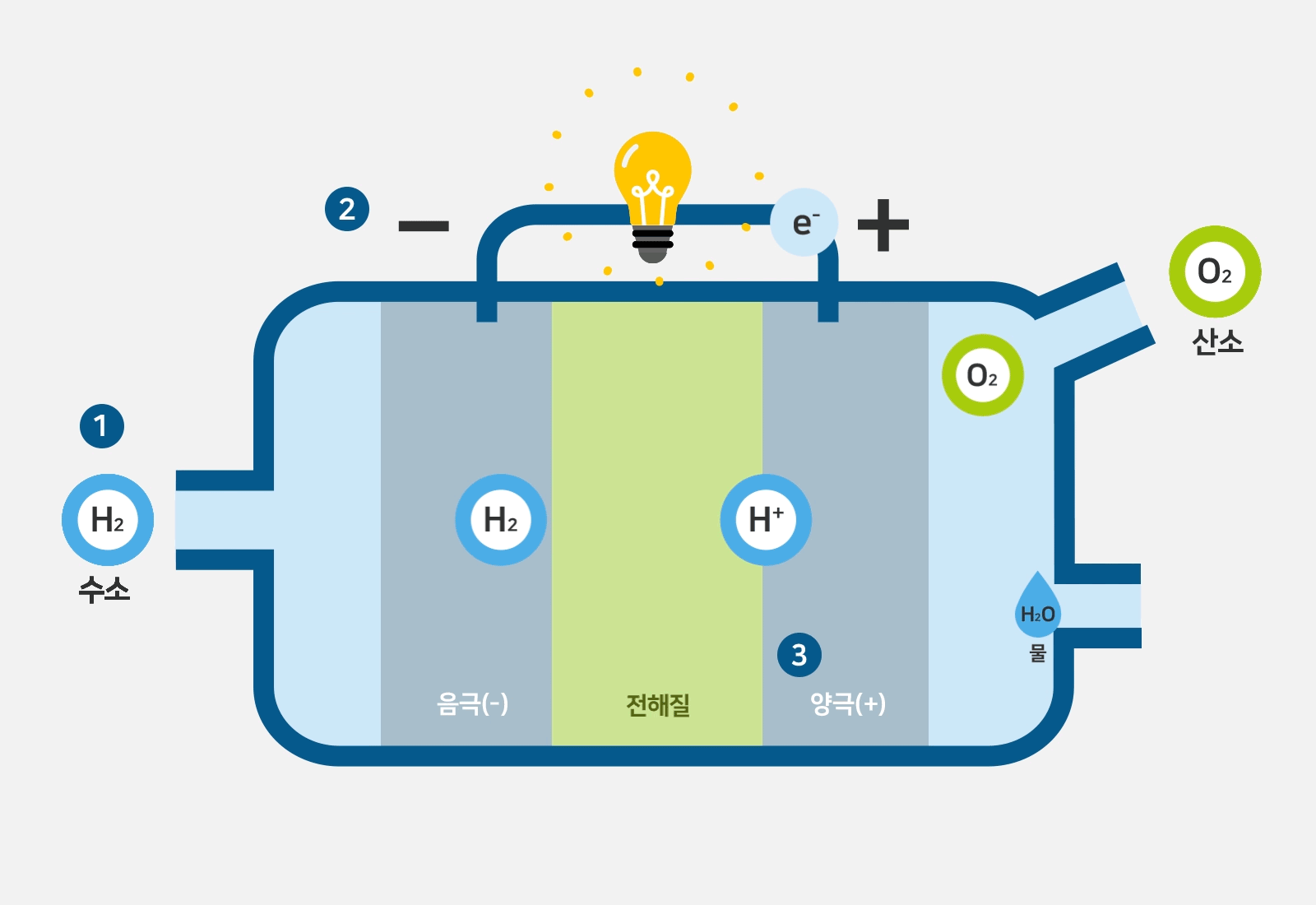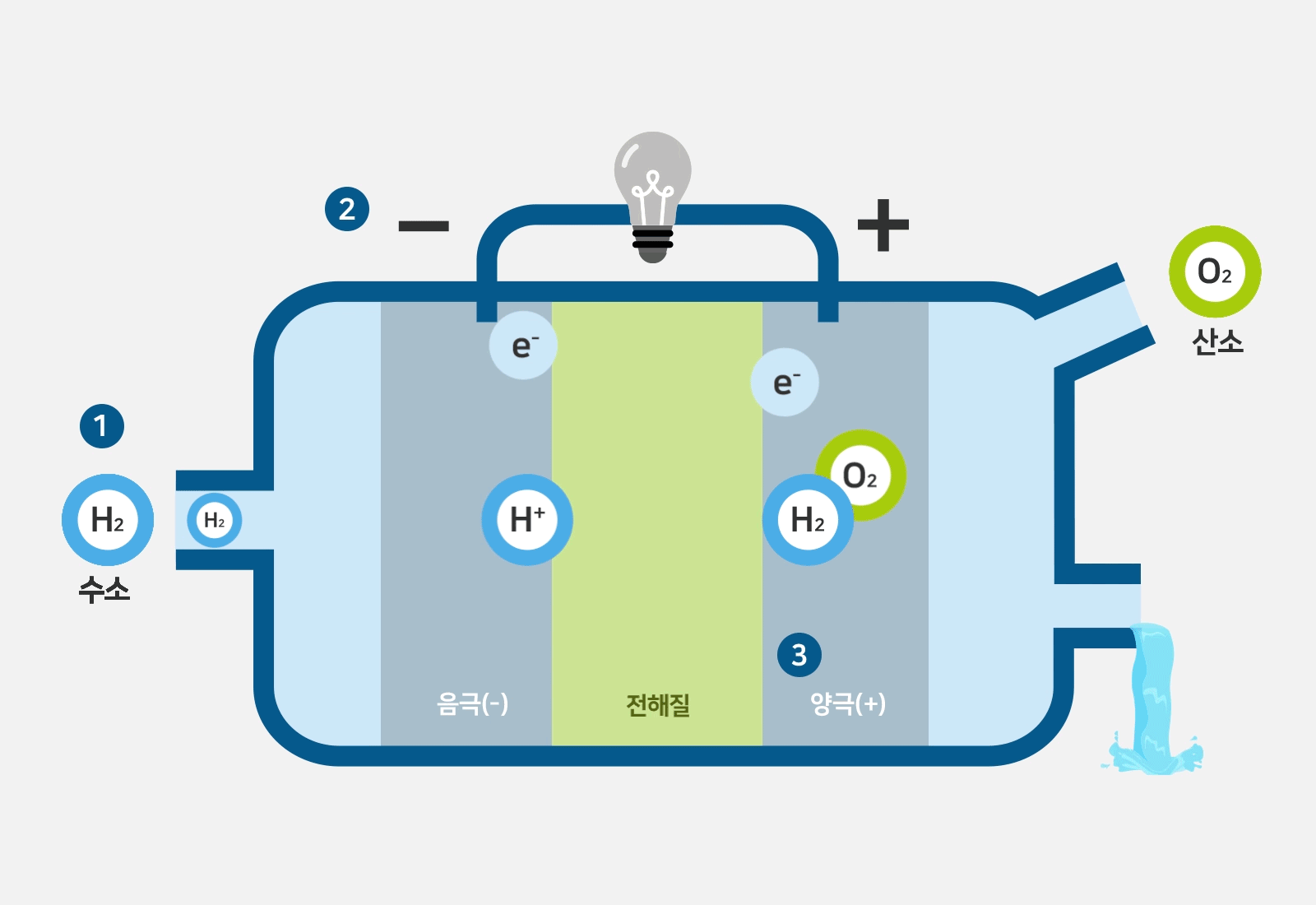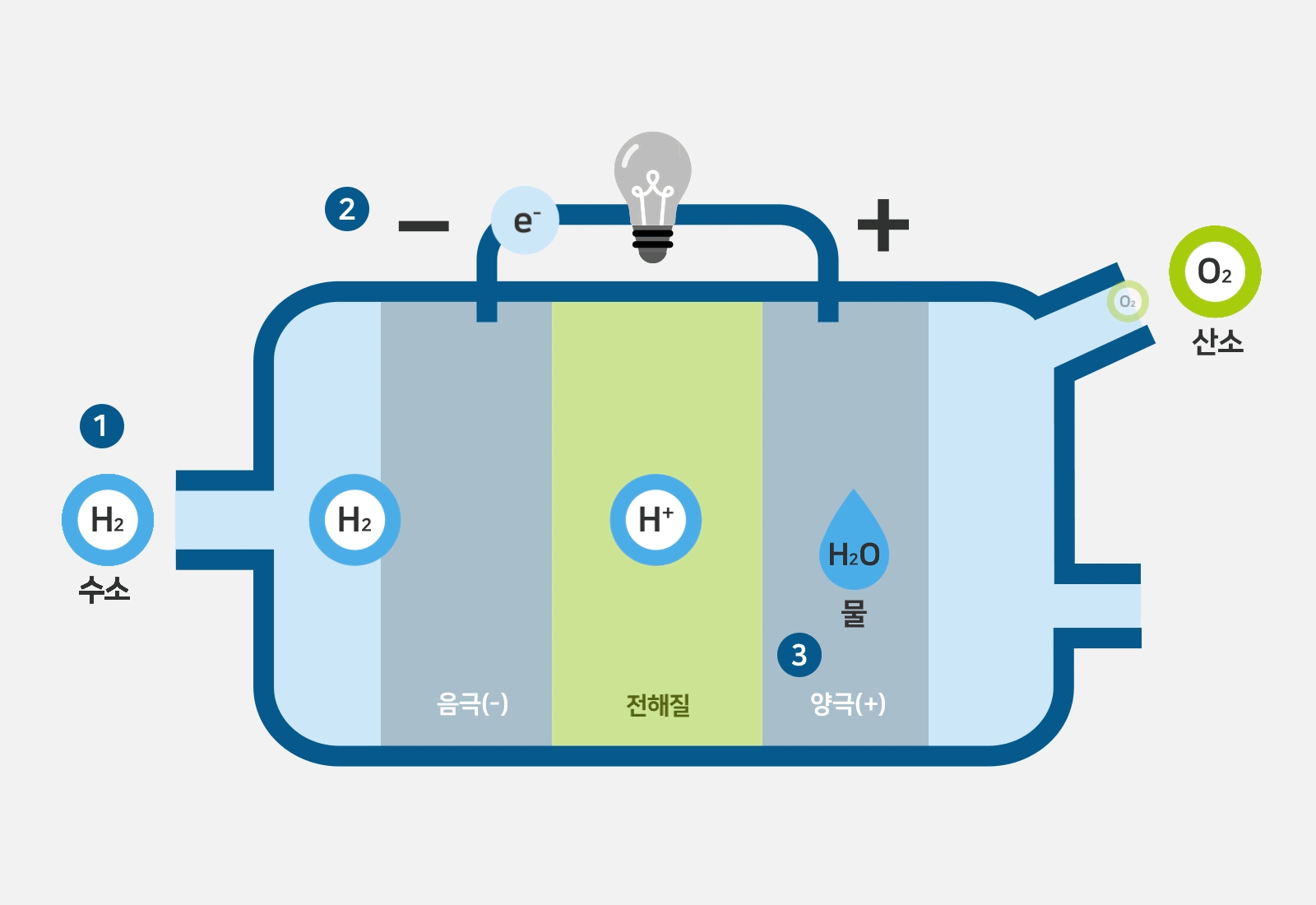
일반적으로 anode는 양극으로, cathode는 음극으로 번역됩니다.
정의에 의하면,
anode는 산화(전자를 잃음)가 되는 전극으로 전자가 나오는 전극,
cathode는 환원(전자를 얻음)이 되는 전극으로 전자가 들어오는 전극입니다.
그런데 그림을 자세히 보면 산화되는 수소반응극이 -,
산소반응극이 + 로 되어있습니다.
즉, 일반적인 번역과는 차이가 있습니다.
연료전지의 경우, 충전이라는 개념이 없습니다.
반면, 충전/방전의 개념이 있는 2차전지의 경우(아래그림)에는,
충전될 때는 왼쪽에서 환원, 오른쪽에서 산화되므로,
왼쪽 전극이 cathode, 오른쪽 전극이 anode가 됩니다.
방전될 때는 왼쪽에서 산화, 오른쪽에서 환원이 되며,
왼쪽 전극이 andoe, 오른쪽 전극이 cathode가 됩니다.
2차전지는 충전이냐 방전이냐에 따라 전극의 역할이 바뀝니다.
즉, 충전과 방전은 서로 전류의 방향이 다르기 때문에 양극(positive electrode)와
음극(negative electrode)의 방향이 계속 바뀝니다.
그래서 사용자의 편의를 위해서 충전을 기준으로 anode를 양극으로 정의하게 됩니다.
2차전지에서 anode를 양극재, cathode를 음극재로 지칭하는 이유이기도 합니다.
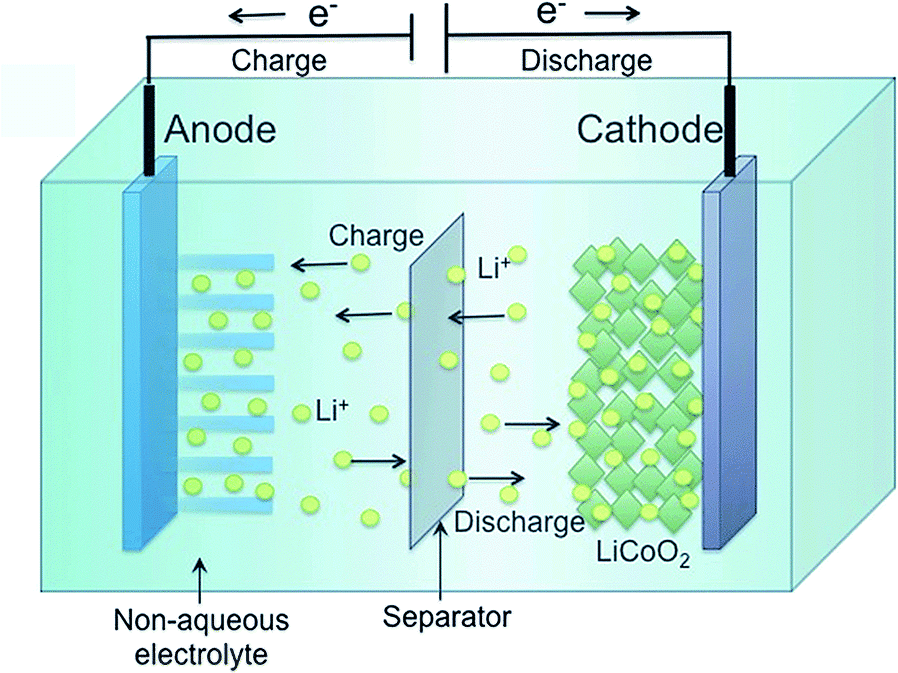
위 그림을 통해서 충전을 기준으로,
전자가 들어오는 쪽인 왼쪽 전극을 andoe로 부르고,
전자가 나오는 쪽인 오른쪽 전극을 cathode로 부르기로 합니다.
방전될 때는 anode가 음극(negative elecrode)
cathode가 양극(positive electrode)가 됩니다.
그런데, 연료전지는 충전의 개념이 없기 때문에
2차전지의 방전처럼 anode가 음극, cathode가 양극이 됩니다.